


來源:醫藥經濟報 發布時間:2016-01-05 浏覽量:1215
作為“十三五”開局之年,2016年也是仿制藥質量和療效一緻性評價落地的一年,業内人士預測,在一系列政策的推動下,“十三五”期間可能出現真正的仿制藥行業大洗牌。
如火如荼的形勢
對于2016年仿制藥質量和療效一緻性評價,業内專家用一個詞來預言——如火如荼。
主管部門2015年11月的兩份文件正是其中關鍵。CFDA在2015年11月接連發布了《關于藥品注冊審評審批若幹政策的公告(2015年第230号)》與征求《關于開展仿制藥質量和療效一緻性評價的意見(征求意見稿)》意見的公告(2015年第231号)。230号文落實了仿制藥一緻性評價作為藥審必要依據、仿制藥生物等效性試驗審批改備案等措施,231号文則給出了仿制藥一緻性評價的時間節點。
2015年12月23日,CFDA召開藥物臨床試驗數據核查工作座談會時重申要加快推進藥品上市許可持有人制度和仿制藥一緻性評價工作。
更關鍵的是,仿制藥質量和療效一緻性評價從過去的強調體外溶出曲線一緻性評價,轉為強調生物等效性的一緻性評價。231号文提出:原則上企業應采用體内生物等效性試驗(BE)的方法進行評價;采用體外溶出度試驗方法進行評價的品種,以後還應當采取BE的方法進行後續評價。
“在當前臨床試驗數據嚴查的背景下,或會出現具有BE研究資質的機構承接意向低下。”有業内資深人士提醒,留給仿制藥企業時間實際上并不多,“十三五”期間可能出現真正的仿制藥行業大洗牌。
按照相關文件給出的時間節點,截至2018年底,國家基本藥物目錄中化學藥品仿制藥口服固體制劑未能通過一緻性評價的,注銷藥品批準文号;自首家品種通過一緻性評價後,其他同品種在3年内未能通過評價的,注銷藥品批準文号;藥品批準文号有效期屆滿時仍未通過評價的,注銷藥品批準文号。
“仿制藥一緻性評價的順利開展需要良好、科學、具實操性的頂層設計。”消息人士透露,明年CFDA将專門成立仿制藥一緻性評價中心。
按照國務院在《關于改革藥品醫療器械審評審批制度的意見》,“通過質量一緻性評價的,允許其在說明書和标簽上予以标注,并在臨床應用、招标采購、醫保報銷等方面給予支持。”換言之,未來與原研藥療效一緻的藥品,有望獲批在藥品外包裝上印出明顯标識,若加上醫療機構集中采購和臨床使用中的優先選用、人社部醫保支付方面的适當支持、工信部對企業技術改造的支持,一緻性評價将帶動仿制藥升級,從根本上改變仿制藥行業現狀。 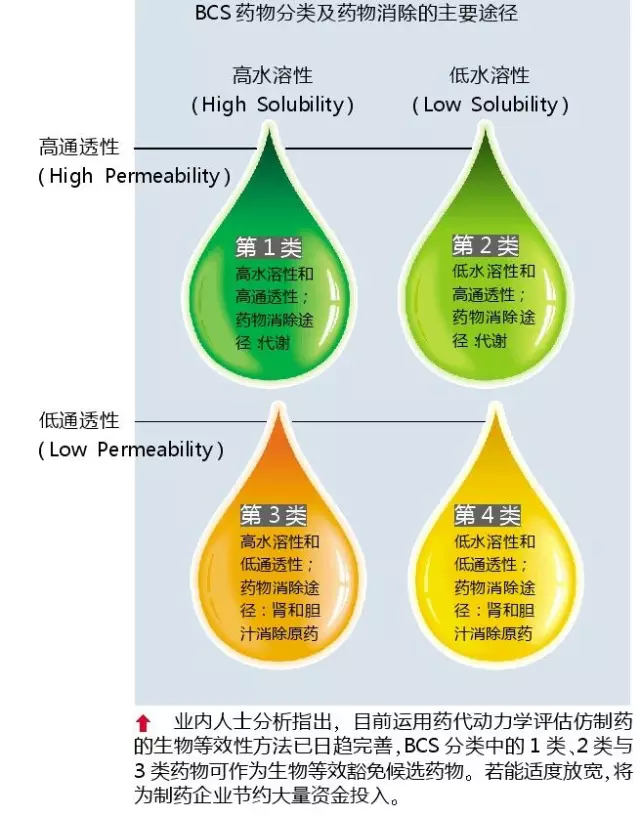
走向國際的暢想
按照CFDA相關文件的表述,通過仿制藥質量和療效與原研藥一緻性評價工作,實現保障公衆用藥安全有效、提升我國制藥行業整體水平、促進醫藥經濟結構調整和産業升級、提高醫藥産業國際競争能力。
從市場競争規律來看,一個藥品面臨幾十上百家仿制,往往會引發惡性價格戰,進一步擠壓利潤空間。
“在确保自家仿制藥産品質量已提升的前提下,進入國際市場是一個不錯的選擇項。”市場分析人士指出,如今歐美各國政府均鼓勵其公民使用仿制藥,加之近年陸續有價值幾百億美元的專利藥專利将到期,仿制藥市場空間巨大。
“可以借鑒印度發展經驗,加快制劑産品出口。”在中國化學制藥工業協會執行會長潘廣成看來,企業要加快引進和培養國際人才,掌握國外法律和市場環境,加快開展國際注冊和生産管理體系國際認證,充實産品線,提高出口制劑産品的附加值。要加強我國制劑産品品牌宣傳推廣,提高國内外用戶認知度。應利用我國原料藥優勢,開發制劑新技術,加強緩釋、控釋、透皮吸收、粘膜給藥、靶向給藥等新型制劑技術藥物的研發和應用。
業内專家指出,中國仿制藥若要進入國際市場,既需要了解和遵循各國現行的仿制藥管理法律法規及申報程序,準備高質量的申報材料,更重要的是,必須應用質量源于設計的藥物研發理念,改進生産和分析技術,提高質量。
潘廣成也提醒企業應主動适應經濟全球化新形勢,推動對内對外開放相互促進,将“引進來”和“走出去”更好結合,提高國際合作水平。他建議,企業要注重在醫藥設計、研發、生産、營銷及臨床試驗領域開展高層次的國際合作,加快藥品國際注冊,擴大産品出口。結合國家“一帶一路”戰略,加強與沿線國家的合作。“同時企業要學習國際醫藥領域法律知識,加強企業合規經營,規避國際交往法律風險,提高醫藥開放型經濟水平和國際貿易順差。”